ธาตุกัมมันตรังสี (radioactive element)
คือธาตุพลังงานสูงกลุ่มหนึ่งที่สามารถแผ่รังสี แล้วกลายเป็นอะตอมของธาตุใหม่ได้ มีประวัติการค้นพบดังนี้
- รังสีเอ็กซ์ ถูกค้นพบโดย Conrad Röntgen อย่างบังเอิญเมื่อปี ค.ศ. 1895
- ยูเรเนียม ค้นพบโดย Becquerel เมื่อปี ค.ศ. 1896 โดยเมื่อเก็บยูเรเนียมไว้กับฟิล์มถ่ายรูป ในที่มิดชิด ฟิล์มจะมีลักษณะ เหมือนถูกแสง จึงสรุปได้ว่าน่าจะมีการแผ่รังสีออกมาจากธาตุยูเรเนียม เขาจึงตั้งชื่อว่า Becquerel Radiation
- พอโลเนียม ถูกค้นพบและตั้งชื่อโดย มารี กูรี ตามชื่อบ้านเกิด (โปแลนด์) เมื่อปี ค.ศ. 1898 หลังจากการสกัดเอายูเรเนียมออกจาก Pitchblende หมดแล้ว แต่ยังมีการแผ่รังสีอยู่ สรุปได้ว่ามีธาตุอื่นที่แผ่รังสีได้อีกแฝงอยู่ใน Pitchblende นอกจากนี้ กูรียังได้ตั้งชื่อเรียกธาตุที่แผ่รังสีได้ว่า ธาตุกัมมันตรังสี และเรียกรังสีนี้ว่า กัมมันตภาพรังสี
- เรเดียม ถูกตั้งชื่อไว้เมื่อปี ค.ศ. 1898 หลังจากสกัดเอาพอโลเนียมออกจากพิตช์เบลนด์หมดแล้ว พบว่ายังคงมีการแผ่รังสี จึงสรุปว่ามีธาตุอื่นที่แผ่รังสีได้อีกใน Pitchblende ในที่สุดกูรีก็สามารถสกัดเรเดียมออกมาได้จริง ๆ จำนวน 0.1 กรัม ในปี ค.ศ. 1902
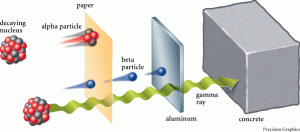
ส่วนรังสีที่แผ่ออกมาจากธาตุนั้น แบ่งเป็น 3 ชนิดคือ
- รังสีแอลฟา (สัญลักษณ์: α) คุณสมบัติ เป็นนิวเคลียสของอะตอมฮีเลียม (4 2He) มี p+ และ n อย่างละ 2 อนุภาค ประจุ +2 เลขมวล 4 อำนาจทะลุทะลวงต่ำ เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วลบ
- รังสีบีตา (สัญลักษณ์: β) คุณสมบัติ เหมือน e- อำนาจทะลุทะลวงสูงกว่า α 100 เท่า ความเร็วใกล้เสียง เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วบวก
- รังสีแกมมา (สัญลักษณ์: γ) คุณสมบัติเป็นคลื่นแม่เหล็กไฟฟ้า (Electromagnetic Wave) ที่มีความยาวคลื่นสั้นมากไม่มีประจุและไม่มีมวล อำนาจทะลุทะลวงสูงมาก ไม่เบี่ยงเบนในสนามไฟฟ้า เกิดจากการที่ธาตุแผ่รังสีแอลฟาและแกมมาแล้วยังไม่เสถียร มีพลังงานสูง จึงแผ่เป็นคลื่นแม่เหล็กไฟฟ้าเพื่อลดระดับพลังงาน จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิมและธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกันเรียกว่า ครึ่งชีวิตของธาตุ
ครึ่งชีวิตของธาตุ (Half life) เรารู้แล้วว่ารังสีที่แผ่ออกมาจากธาตุกัมมันตรังสีเกิดจากนิวเคลียสในอะตอมของธาตุซึ่งไม่เสถียร จึงต้องมีการสลายตัวและแผ่รังสีออกมา เพื่อเปลี่ยนไปเป็นอะตอมที่มีเสถียรภาพมากขึ้น เมื่อธาตุกัมมันตรังสีแผ่รังสีออกมาแล้วจะเกิดการสลายตัวลดปริมาณลงไปด้วย โดยนักวิทยาศาสตร์เรียกระยะเวลาที่ธาตุกัมมันตรังสีสลายตัวไปจนเหลือครึ่งหนึ่งของปริมาณเดิมว่า ครึ่งชีวิต (Half life) ตัวอย่างเช่น ธาตุซัลเฟอร์ -35 มีครึ่งชีวิต 87 วัน ในการสลายตัวเหลือ 4 กรัม และใช้เวลาอีก 87 วัน ในการสลายตัวจนเหลือ 2 กรัม เป็นต้น
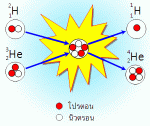
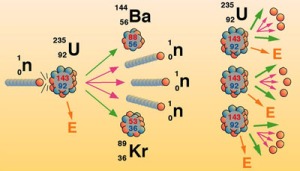
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ 1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
 ประโยชน์ของธาตุกัมมันตรังสี ความสามารถในการปลดปล่อยพลังงาน และรังสีที่มีพลังงานและมีอำนาจทะลุทะลวงของธาตุกัมมันตรังสีได้ถูกนำไปประยุกต์ใช้ให้เกิดประโยชน์ในด้านต่าง ๆ มากมายทั้งในด้านการแพทย์ การเกษตร อุตสาหกรรม รวมจนถึงด้านธรณีวิทยาการหาอายุของวัตถุต่าง ๆ โดยธาตุกัมมันตรังสีที่มีการใช้ประโยชน์กันอย่างกว้างขวาง ได้แก่
ประโยชน์ของธาตุกัมมันตรังสี ความสามารถในการปลดปล่อยพลังงาน และรังสีที่มีพลังงานและมีอำนาจทะลุทะลวงของธาตุกัมมันตรังสีได้ถูกนำไปประยุกต์ใช้ให้เกิดประโยชน์ในด้านต่าง ๆ มากมายทั้งในด้านการแพทย์ การเกษตร อุตสาหกรรม รวมจนถึงด้านธรณีวิทยาการหาอายุของวัตถุต่าง ๆ โดยธาตุกัมมันตรังสีที่มีการใช้ประโยชน์กันอย่างกว้างขวาง ได้แก่
1 ยูเรเนียม-235 (U-235) ใช้สำหรับเป็นเชื้อเพลิงในโรงไฟฟ้าพลังนิวเคลียร์ ใช้ในอุตสาหกรรมการผลิตเครื่องบินและยานอวกาศ และใช้ในการผลิตรังสีเอ็กซ์ (X-ray) ซึ่งมีพลังงานสูง
2 โคบอลต์-60 (Co-60) เป็นธาตุกัมมันตรังสีที่สามารถแผ่กัมมันตรังสีชนิดแกมมาซึ่งมีผลในการยับยั้งการเจริญเติบโตของเซลล์ได้ จึงมีการนำมาใช้ในการยับยั้งการเจริญเติบโตเชื้อจุลินทรีย์ในอาหาร ผักและผลไม้ และนำมาใช้ในการรักษาโรคมะเร็ง
3 คาร์บอน-14 (C-14) เป็นธาตุกัมมันตรังสีที่สามารถพบได้ในวัตถุต่าง ๆ เกือบทุกชนิดบนโลก จึงสามารถนำระยะเวลาครึ่งชีวิตของธาตุนี้มาใช้ในการคำนวณหาอายุของวัตถุโบราณ อายุของหินและเปลือกโลกและอายุของซากฟอสซิลต่าง ๆ ได้ (C-14 มีครึ่งชีวิตประมาณ 5,730 ปี
4 ฟอสฟอรัส-32 (P-32) เป็นสารประกอบกัมมันตรังสีที่สามารถละลายน้ำได้ มีระยะเวลาครึ่งชีวิตประมาณ 14.3 วัน ทางการแพทย์นำมาใช้ในการรักษาโรคมะเร็งของเม็ดโลหิตขาว (ลิวคีเมีย) โดยให้รับประทานหรือฉีดเข้าในกระแสโลหิต นอกจากนี้ยังสามารถใช้ในการตรวจหาเซลล์มะเร็ง และตรวจหาปริมาณโลหิตของผู้ที่จะเข้ารับการผ่าตัด
อันตรายจากธาตุกัมมันตรังสี อันตรายจากธาตุกัมมันตรังสีเกิดขึ้นได้ เนื่องจากหากร่างกายของสิ่งมีชีวิตได้รับกัมมันตรังสีในปริมาณที่มากเกินไปจะทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่าง ๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ซึ่งจะทำให้สิ่งมีชีวิตเกิดความเจ็บป่วย หรือหากได้รับในปริมาณมากก็อาจทำให้เสียชีวิตได้ ดังนั้นผู้ปฏิบัติงานที่เกี่ยวข้องกับรังสีจึงจะต้องมีอุปกรณ์ที่ช่วยป้องกันอันตรายจากรังสี และมีการกำหนดระยะเวลาในการทำงานเพื่อไม่ให้สัมผัสกับรังสีเป็นเวลานานเกินไป



 และ
และ  คือ ค่าอิเล็กโทรเนกาทิวิตีที่เสนอโดยเพาลิงของอะตอม A และ อะตอม B ตามลำดับ โดยพบพันธะชนิดนี้เกือบทั้งหมดในของแข็ง
คือ ค่าอิเล็กโทรเนกาทิวิตีที่เสนอโดยเพาลิงของอะตอม A และ อะตอม B ตามลำดับ โดยพบพันธะชนิดนี้เกือบทั้งหมดในของแข็ง